Nature :肥胖或可成为肿瘤免疫治疗的参考标志物
肿瘤免疫治疗因其显著的生存获益已成为肿瘤治疗的新型手段,免疫检查点抑制剂也已被批准用于多种晚期肿瘤的治疗,尽管免疫检查点抑制剂对部分肿瘤患者有较好的疗效,但大部分肿瘤患者仍然是无法从中获益的。
目前很多研究都在积极探索癌症免疫治疗的生物标志物,但大部分研究都集中在肿瘤微环境(TME)或肿瘤突变负荷(TMB),而与患者相关的因素如性别、年龄、体重指数(BMI)和免疫状况却很少有人关注。
研究亮点
来自加州大学戴维斯分校的研究人员揭示了肥胖与肿瘤生长及免疫的关系,该研究结果发表在《Nature Medicine》上。研究人员将肥胖(BMI≥30kg/m2)作为一些癌症免疫疗法的生物标志物,并通过多种携带肿瘤的模式动物证明:肥胖会导致肿瘤进展和PD-1介导的T细胞功能障碍增加;有趣的是,该研究还发现了肥胖能够提高携带肿瘤的小鼠和临床癌症患者免疫检查点抑制剂的疗效。这可以为医生在面对不同患者时,考虑不同治疗方案提供一种新的思路。
1、在多种物种中,肥胖与T细胞功能障碍相关
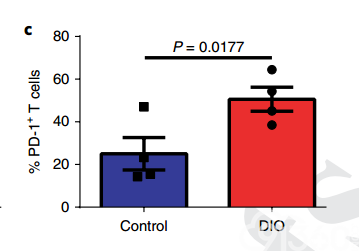
研究人员研究了对照组小鼠(10%脂肪饮食组)与饮食诱导的肥胖小鼠(DIO组,60%脂肪饮食)在6个月和11-12个月时的T细胞表型和功能。结果显示,DIO组中小鼠的T细胞的PD-1表达比对照组增加了2倍左右。为了确定DIO组小鼠中增加的PD-1表达是否指示T细胞功能障碍,研究人员检查了耗竭指标,包括减少增殖功能和细胞因子的产生。结果显示,与对照组相比,来自DIO组的小鼠多克隆T细胞显示出增殖能力降低,以及IFNγ和TNFα产生减少的现象。
研究人员接下来又评估了恒河猴(NHP,远交非人类灵长类动物)和人类的肥胖影响,并观察到非常相似的现象。来自自发肥胖的NHP的T细胞表现出记忆库和PD-1表达的显着增加,同时与非肥胖NHP相比增殖能力也有降低。在健康人群,来自肥胖(BMI≥30)健康人的T细胞相较于非肥胖(BMI <30)健康人的T细胞也表现出PD-1表达的显着增加以及增殖功能降低的现象。这些结果都表明,肥胖与T细胞增殖能力相关。
2、肥胖促进肿瘤生长
接下来,研究人员又对比了对照组小鼠(10%脂肪饮食组)与饮食诱导的肥胖小鼠(DIO组,60%脂肪饮食)肿瘤进展情况,与对照组相比,在6个月大的DIO小鼠中B16黑素瘤肿瘤生长明显更快,且在DIO小鼠中的肿瘤表现出更强的代谢活性,从下图可以看到DIO小鼠中黑素瘤肿瘤具有更大的溃疡、坏死和皮下脂肪侵入,且与研究人员先前在未携带肿瘤小鼠中发现的情况一致,DIO小鼠的TME中的T细胞表现出疲惫的特征。
研究人员通过流式细胞术发现,与对照小鼠相比,DIO小鼠的肿瘤浸润性CD8+ T细胞(CD8+ TIL)中PD-1、Tim3和Lag3具有更高的表达,并且Ki67显示出增殖水平更低。因为调节性T细胞(Tregs)在TME中发挥了作用,并且在肥胖中发生了改变。研究人员还检查了TME中的Tregs,并没有观察到DIO和对照小鼠之间Tregs频率的差异,也没有PD-L1表达的差异。
3、瘦素水平与PD-1表达相关
瘦素特征性的高水平存在于肥胖中,没有证据表明它与PD-1表达相关,但是研究发现它可以影响T细胞的功能。在健康的志愿者中,研究人员观察到肥胖人群的血清中瘦素水平显著增加,这与CD8+ T细胞上的PD-1表达相关。类似地,DIO小鼠中瘦素水平升高,这与CD8+ T细胞上PD-1的频率升高相对应。使用随意(AL)喂养的小鼠与年龄匹配的卡路里限制(CR)小鼠对比,通过磁共振成像发现,CR小鼠与AL小鼠相比,内脏脂肪更低、体重更轻并且瘦素水平也更低,由于体脂减少而导致的瘦素和T细胞功能障碍随着年龄增长而降低。
研究人员接下来检查了瘦素缺陷型ob/ob和瘦素受体(ObR)缺陷型db/db小鼠中的T细胞表型,这两种小鼠由于缺乏饱腹感而导致肥胖。正如预期的那样,db/db小鼠的体重显著高于同等年龄的野生型(WT)对照小鼠,但db/db小鼠中CD8+ T细胞的PD-1表达频率显著低于WT对照小鼠。在ob/ob小鼠中观察到类似的结果。
这些结果表明瘦素不是CD8+ T细胞上PD-1表达所必需的,但在肥胖的情况下,完整的瘦素信号传导有助于PD-1表达呈现阳性。
4、肥胖改善DIO小鼠中PD-1检查点阻断的效果
基于之前的观察结果,我们知道肥胖能够导致CD8+ T细胞的耗竭和功能障碍,接下来研究人员评估了PD-1阻断对肿瘤生长的影响,发现使用抗PD-1作为单一疗法对对照小鼠具有极小的影响,但在DIO小鼠中,却观察到B16肿瘤负荷的显著降低,并且存活率有明显改善。在3LL-肿瘤的DIO小鼠中也观察到类似的结果。
这些结果表明,在PD-1单药治疗效果有限(B16)或对单药治疗易感性(3LL)的模型中,DIO小鼠的治疗效果显着高于对照组。进一步研究发现,DIO小鼠的反应性改善与肿瘤浸润性T细胞总数显著增加和TME中CD8+ T细胞频率增加有关。
总体来说,PD-1疗法缓解了CD8+ T细胞的耗竭,并显著提高了DIO小鼠的存活率。重要的是,尽管肥胖小鼠在免疫治疗后存在严重或致命毒性的风险,但在PD-1检查点阻断后没有观察到AEs(不良事件)。这意味着在肥胖的情况下,疗效和毒性风险会脱钩,这可能取决于所使用的免疫疗法类型。
5、肥胖对PD-1表达以及免疫检查点阻滞的影响
因为在肥胖小鼠模型中用PD-1疗法观察到显著的抗肿瘤作用,研究人员检查了人类肥胖癌症患者TME中的T细胞表型。在大队列——152个人类结肠直肠癌(CRC)中观察到肥胖患者的肿瘤浸润性T细胞显著减少。
由于CRC患者对检查点阻滞的反应率较低,研究人员还检查了黑色素瘤的情况。在一组有251名黑色素瘤的患者中,来自癌症基因组图谱(TCGA)的注释临床数据显示,在肥胖患者的肿瘤中PD-1表达平均增加1.57倍(P = 0.019)(BMI≥30)。在60岁以上(n = 126)的患者中,肥胖对TME中耗竭标志物表达的影响更为明显,肥胖患者PDCD1(PD-1)增加3倍,HAVCR2(Tim3)增加了两倍,LAG3增加了三倍,TIGIT增加2.3倍,TBX21(T-bet)增加2.2倍,EOMES增加1.79倍。
最重要的是,研究发现肥胖(BMI≥30)患者相较于非肥胖(BMI<30)患者,临床结果有显著改善。在一组250名使用PD-1/PD-L1检查点抑制剂的癌症患者中,与对照组相比,肥胖患者mPFS(中位无进展生存期)(237天 VS. 141天,P = 0.0034)和mOS(中位总生存)(523天 VS. 361天,P = 0.0492)有统计学上的显著差异。与肥胖小鼠一样,肥胖患者的免疫相关不良反应没有增加。
这个研究首次证明,在多种物种和肿瘤模型中,肥胖会增加T细胞衰老,从而导致更高的PD-1表达和功能障碍,这至少部分是由瘦素信号传导驱动的。而且还观察到在肥胖环境中肿瘤进展增加,这可能是由于免疫抑制的效应。更重要的是,肥胖情况下,癌症中PD-1介导的T细胞功能障碍使肿瘤对检查点阻断更为敏感,这些临床前研究结果得到临床数据的证实,证明用PD-1/PD-L1抑制剂治疗的肥胖癌症患者的预后有明显改善。
参考资料:
Ziming Wang et al, Paradoxical effects of obesityon T cell function during tumor progression and PD-1 checkpoint blockade, Nature Medicine (2018). DOI:10.1038/s41591-018-0221-5

我要评论