软组织和骨肿瘤的分子病理学发展十分迅速,不仅在传统的诊断和鉴别诊断中起了十分重要的作用,在指导临床制定软组织和骨肿瘤治疗策略和预测肿瘤生物学行为等方面也发挥着重要的角色。另一方面,基于分子异常的新病种报道也在不断涌现,肿瘤分类的基础正在从形态学分类转向分子分类。中华医学会病理分会骨和软组织疾病学组、中国抗癌协会肿瘤病理专业委员会骨与软组织疾病学组和中国抗癌协会肉瘤专业委员会病理学组组织专家编写第一版《软组织和骨肿瘤分子病理学检测专家共识(2019年版)》,并在以后的版本中不断加以修订和更新,旨在规范分子病理学检测在软组织肿瘤领域内的应用。
1.分子病理学检测在软组织和骨肿瘤应用中的注意事项
开展分子病理学检测时应注意以下几个问题:(1)分子病理室的总体要求(包括实验室的区域设置、开展的检测项目和应用的试剂、检测人员/数据分析人员/报告签署医师等人员的资质等)应参考相应的管理办法、工作导则、指南和共识[1-4];(2)从事临床基因扩增检验的分子病理实验室需通过临床基因扩增检验实验室技术审核。从事临床基因扩增检验实验技术人员需经过临床基因扩增检验实验技术人员上岗培训;(3)分子病理室应具有严格的室内质控措施,定期参加室间质评,并有持续的质量保证和改进计划;(4)当分子病理学检测结果与临床病理诊断严重不符时,尤其是检测结果与临床治疗密切相关时,需仔细分析原因,必要时重复检测,或请其他有资质的单位复查。
2.软组织和骨肿瘤常用的分子病理学检测方法
常用的分子病理学检测方法为荧光原位杂交(fluorescence in situ hybridization,FISH),其次为聚合酶链反应(polymerase chain reaction,PCR)和一代测序(Sanger 测序)。新的检测技术包括二代测序(next-generation sequencing, NGS)等目前开展尚有限。
2.1 FISH检测
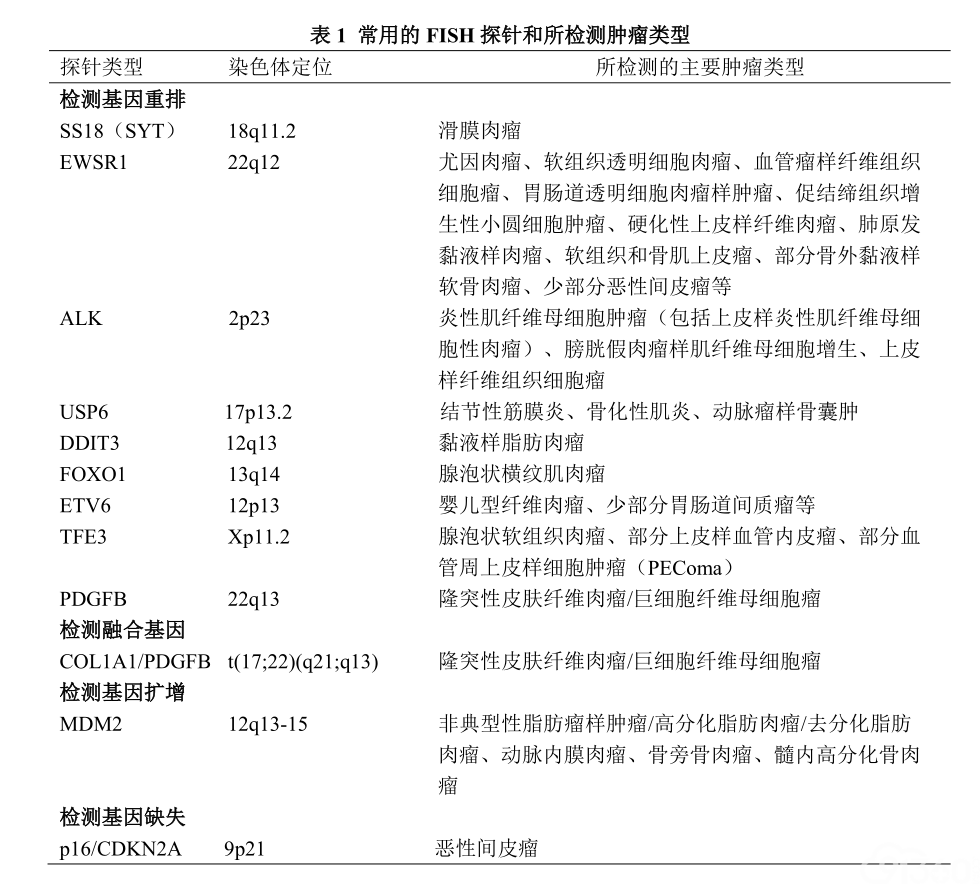
软组织和骨肿瘤FISH检测最常用的探针是α-卫星DNA探针和位点特异性(或基因特异性)DNA探针。在实际工作中所使用的探针绝大多数均为断裂-分离探针(break-apart probe),检测某种基因是否有易位或重排(表1,表2),但不能判定其伴侣基因。理想情况下采用融合探针(fusion probe)可以帮助确定具体的基因融合类型,但一些肿瘤拥有多个伴侣基因,部分伴侣基因发生频率低,如均采用融合探针检测则成本高,并不适合常规开展。少数情况下,采用融合探针检测融合基因优于采用断裂-分离探针检测基因重排,如检测隆突性皮肤纤维肉瘤中的COL1A1-PDGFB融合基因时宜采用融合探针,另一种情况是当两个融合基因位于同一染色体相邻近区域时采用融合探针,如检测BCOR重排肉瘤中的BCOR-CCNB3融合基因。同一伴侣基因位于不同染色体时可采用三色探针,如检测CIC重排肉瘤中的CIC-DUX4融合基因。
对FISH检测结果要注意辩证分析,因一些不同类型的肿瘤均可涉及同一基因易位(如EWSR1基因和FUS基因等),或共享相同的融合基因(如EWSR1-CREB1融合基因),诊断时需要结合病理形态学和免疫组化等其他辅助检查进行综合研判。
多色FISH检测如光谱核型分析(spectral karyotyping,SKY)、多色FISH(M-FISH)和复合二重比FISH(COBRA-FISH)等,采用不同颜色的荧光染色,标记全部染色体,可在一个杂交实验中展现整个染色体组的复杂重组。这些检测方法主要应用于研究性工作。
2.2 逆转录 聚合酶链式反应(reverse transcription-polymerase chain reaction, RT-PCR )可与FISH配伍,主要用于确定融合基因的具体类型,并可通过DNA测序确定具体的融合位点。建议国内从事软组织肿瘤分子病理学检测的单位,除开展FISH检测外,也同时开展RT-PCR检测技术。
需注意的是,RT-PCR以RNA为基础,常因石蜡组织中提取的RNA质量差而失败。此外,RT-PCR也以PCR为基础,容易因PCR的交叉污染而出现假阳性。RT-PCR需设置两种污染对照:一种为无RNA模板的对照(检测PCR试剂的污染),另一种是无逆转录酶的对照(检测患者RNA样本污染)。有条件的单位可开展实时RT-PCR,减少交叉污染的危险性。
2.3 PCR和一代测序(Sanger测序)
主要用于检测软组织和骨肿瘤中的基因突变(表3)。RT-PCR产物通过测序,可确定基因融合点。
2.4 新的分子检测技术
包括单核苷酸多态性阵列、基因表达微阵列分析、RNAseq、基于锚定多重PCR的靶向NGS和基于荧光的NanoString nCounter等,有助于发现软组织肿瘤中新的基因异常,对软组织肉瘤的分子诊断和潜在的靶向治疗具有重要的价值,有条件的单位应积极开展。
2.5 其他检测方法
显色原位杂交(chromogenic in situ hybridization, CISH)可替代 FISH 法来检测某些基因改变,但CISH方法中可被光学显微镜分辨的颜色种类非常有限,CISH应用侧重于检测数量的变化(例如非整倍体和扩增)。传统的比较基因组杂交技术(comparative cenomic hybridization, CGH)和阵列CGH主要用于检测基因获得或缺失变化,不能检测到平衡染色体易位,主要应用于研究性工作。
3.免疫组化标记检测软组织和骨肿瘤中的分子改变
根据软组织和骨肿瘤中的分子改变或基因表达谱而研制的抗体有着一定的辅助诊断价值(表 4),如CD117和DOG1辅助诊断胃肠道间质瘤,ALK辅助诊断炎性肌纤维母细胞瘤,MUC4辅助诊断低度恶性纤维黏液样肉瘤和硬化性上皮样肉瘤等,但也有一些抗体并不特异,如 Fli1、TLE1、MDM2、SATB2和BCOR等,需注意辨证分析。
4.软组织和骨肿瘤的分子检测与靶向和免疫治疗
目前能应用靶向或免疫治疗的软组织和骨肿瘤类型还十分有限,除了骨巨细胞瘤、胃肠道间质瘤和炎性肌纤维母细胞瘤等有限的几种肿瘤以外,大多数尚处在临床试验中,但有着令人鼓舞的应用前景(表 5)。
《软组织和骨肿瘤分子病理学检测专家共识(2019年版)》编写专家委员会
执笔者:张红英 王坚
执笔统筹:王坚
顾问:朱雄增 范钦和 黄啸原 蒋智铭 王瑞林
编写专家委员会成员(按姓氏笔画排列):丁岚 丁宜 丁洋 力超 王立峰 王坚 王国平 王素英 王家耀 王朝夫 毛荣军 石怀银 石慧娟 白辰光 印洪林 冯振忠 曲利娟 朱振龙 刘春霞 刘秋雨 刘保安 刘绮颖 闫庆娜 汤显斌 孙昆昆 孙柯 贡其星 李扬 李传应 李海 李锋 李道明 杨丽 杨桂芳 肖维华 吴勇军 余宏宇 张仁亚 张红英 张宏图 张真真 张海芳 张惠箴 张雷 陆竞艳 陈小岩 陈军 陈丽荣 陈秀明 陈骏 武卫华 林旭勇 金亦 庞宗国 郑雄伟 宗园媛 孟刚 赵志华 胡桂明 相磊 哈德提·别克米托夫 钟定荣 段亚琦 侯刚 饶晓松 饶慧兰 姜杰 袁传涛 顾学文 徐如君 徐国蕊 徐钢 徐瑾 郭冰沁 黄波 黄榕芳 梅开勇 阎晓初 蒋谊 蒋敏 韩安家 粟占三 喻林 程虹 游淑源 路名芝 樊利芳 戴文斌
参考文献
2.中华人民共和国卫生部. 医疗机构临床基因扩增检验实验室管理办法[S].2010-12-06.
3.中华人民共和国卫生部. 肿瘤个体化治疗检测技术指南(试行)[S].2015-7-31.
5.Gupta R, Cooper WA, Selinger C, et al. Fluorescent in situ hybridization in surgical pathology practice [J]. Adv Anat Pathol,2018,25(4):223-237.
6.Fisher C. The diversity of soft tissue tumours with EWSR1 gene rearrangements: a review [J]. Histopathology,2014,64:134-150.
7.Mertens F, Tayebwa J. Evolving techniques for gene fusion detection in soft tissue tumours. Histopathology,2014,64(1):151-162.
8.Groisberg R, Roszik J, Conley A, et al. The role of next-generation sequencing in sarcomas: evolution from light microscope to molecular microscope [J]. Curr Oncol Rep,2017,19(12):78.
9.Szurian K, Kashofer K, Liegl-Atzwanger B. Role of next-generation sequencing as a 7 diagnostic tool for the evaluation of bone and soft-tissue tumors [J]. Pathobiology,2017,84(6):323-338.
10.Lam SW, Cleton-Jansen AM, Cleven AHG, et al. Molecular analysis of gene fusions in bone and soft tissue tumors by anchored multiplex PCR-based targeted next-generation sequencing [J]. J Mol Diagn, 2018,20(5):653-663.
11.Bovée JVMG. Molecular pathology of bone tumors: what have we learned and how does it affect daily practice [J]? Surg Pathol Clin,2017;10(3):xiii-xiv.

我要评论