
韩昱晨
上海市胸科医院病理科主任
中华医学会病理学分会胸部学组委员
中国研究型医院学会病理学分会胸肺科学组副主任委员
中国医疗保健国际交流促进会病理专业委员会常委
中华病理学杂志通讯编委
上海市临床病理质量控制中心分子病理工作组专家
免疫治疗,诊断先行
不同于传统化疗手段,肿瘤免疫治疗通过调动机体的免疫系统,增强或正常化人体抗肿瘤免疫系统,从而抑制和杀伤肿瘤细胞。由于能够提供持久的疗效,让长期生存成为可能,以PD-1/PD-L1免疫检查点抑制剂为代表的免疫治疗是肿瘤治疗领域中最具前景的研究方向之一。PD-1/PD-L1免疫检查点抑制剂取得的突破性临床研究进展也正迅速改变着多种肿瘤的治疗模式[1],对临床诊疗实践提出了新的挑战。
上海市胸科医院病理科主任韩昱晨教授指出:“免疫治疗的第一步是病理诊断。目前广泛应用的PD-1/ PD-L1单抗虽然属于广谱抗肿瘤治疗药物,然而仍需筛选出真正可能获益的患者给予治疗,一方面可以提高治疗疗效,另一方面也可以尽可能避免无效治疗。积累中国人群的临床实践数据,更精准地指导临床诊疗也是当务之急。对于如何通过病理诊断筛选出从免疫治疗中真正获益的患者群,一直是临床研究的热点。”
PD-L1检测是目前筛选获益患者唯一标准
大量研究表明,肿瘤组织样本中PD-L1表达水平越高,则意味着患者更可能从PD-1/PD-L1抑制剂治疗中获益[2]。肿瘤组织PD-L1表达水平评估是目前临床研究、验证和认可度最广泛的PD-1/PD-L1抑制剂疗效预测标志物。而免疫组化方法学是目前临床诊断级别评估肿瘤组织PD-L1表达水平的唯一方法学。目前FDA获批具有代表性的4种PD-1/PD-L1单抗(nivolumab、pembrolizumab、atezolizumab和durvalumab)都有相对应的伴随诊断联合使用,在临床诊疗实践中,到底是应该先选择PD-L1检测方法还是先选择治疗药物?不如,先来看看检测适应症与关联药物的比较:

表1.FDA/CE IVD已获批的4种PD-L1检测汇总
从国际上已报道的研究来看,针对以上4种PD-L1表达检测,2017年发布在《Clinical Cancer Research》杂志上的一项研究显示,SP263和22C3、28-8具有较好的一致性,在PD-L1肿瘤细胞膜染色不同阈值(1%、10%、25%和50%)的比较上,三种方法的总体一致率>90%[10]。由国际肺癌研究协会(IASLC)发起的Blue Print 1和Blue Print 2研究显示出相似的结果[11],[12]。相比之下, SP142检测肿瘤细胞PD-L1表达需要更高的阈值,但在免疫细胞的检测上具有更好的敏感性[11],从最新的研究更新来看,SP142在需要或仅需要评估免疫细胞PD-L1表达水平的适应症上具有显著优势。值得注意的是,VENTANA PD-L1(SP263)可以同时检测细胞膜和细胞浆中的PD-L1表达,欧盟体外诊断医疗器械(CE IVD)认证批准可同时指导nivolumab、pembrolizumab和durvalumab治疗[1],[3],[10]是目前国际上关联药物最多的检测[1]。
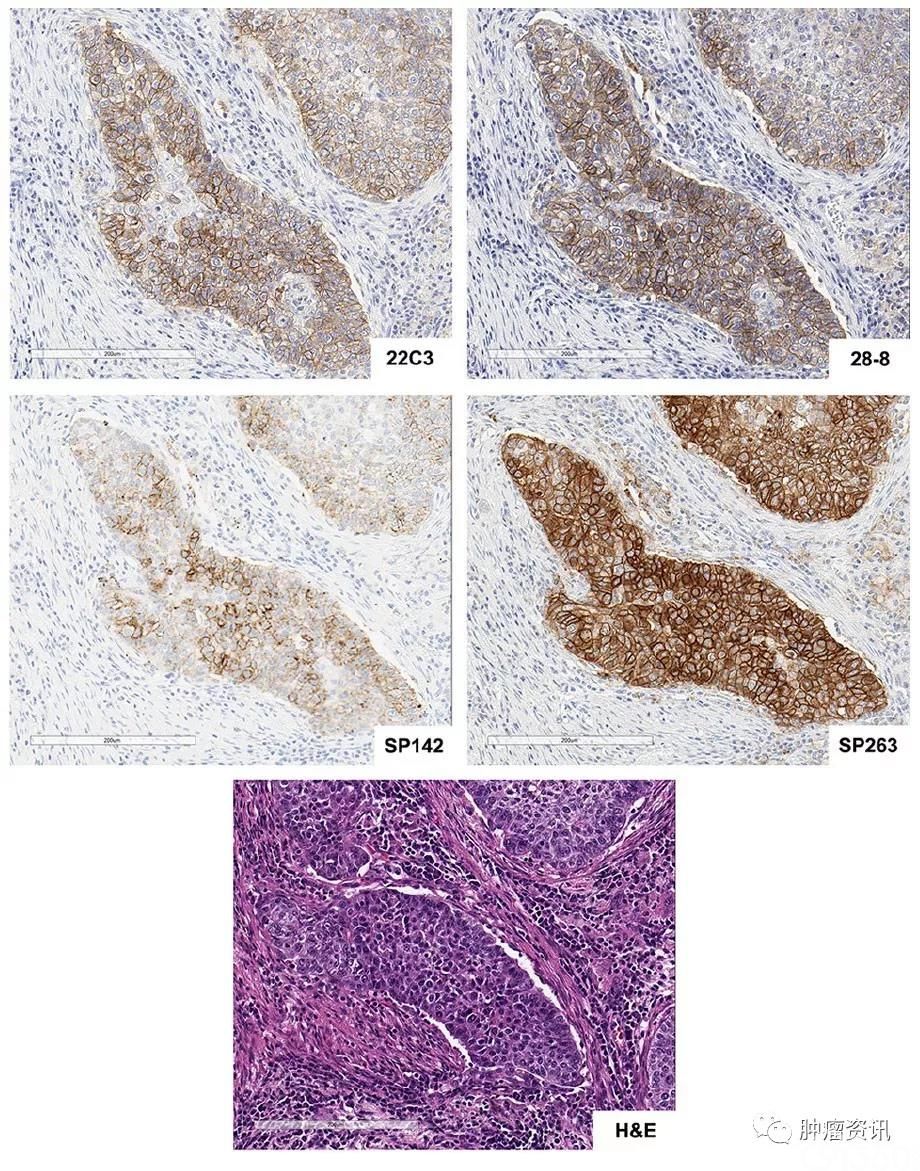
图1.非小细胞肺癌(NSCLC)组织HE染色(20X)及4种FDA/CE IVD认证获批PD-L1检测染色图示(20X). Hirsch, Fred R., et al. Journal of Thoracic Oncology12.2(2017): 208-222.
PD-L1检测发展方向
2018年是中国免疫治疗的元年,4款PD-1单抗类药物先后获批上市,然而中国市场暂时还没有用于疗效预测评估的PD-L1伴随诊断获批上市,这对于临床医生在制定治疗决策时,如何评估患者从PD-1/PD-L1单抗类药物治疗方案获益情况提出了挑战。
“目前获批的药物及适应症均有各自的伴随诊断检测和判读体系,但由于晚期非小细胞肺癌肿瘤组织样本有限,因此临床实践中在优先保证PD-L1检测标准化、准确的前提下,应综合考虑,尽可能避免过度检测和标本的浪费。SP263检测在CE IVD认证的一致性评价获批[1],[3],[10]带给我们一些启示,从各药企已披露的临床实验进展来看,预期未来还会有更多的PD-1/PD-L1抗体类药物获批上市,因此从医药经济学角度考虑,在实践中选择经临床验证、法规审批、关联药物较多的PD-L1检测用于PD-L1表达水平的初步评估或值得探索。”韩昱晨教授总结道,“免疫治疗开启的肿瘤诊疗新时代,对病理科的发展也提出了新的挑战。PD-L1检测规范化标准化建设任重道远,除了抗体、检测平台、评价方法体系的选择,探索基于中国人群研究的多种标志物联合评价也将有助于PD-L1检测更好地指导PD-1/PD-L1抑制剂疗效的预测。”
参考文献:
[1] 2018 ESMO handbook of immune-oncology.
[2] Hegde, Priti S., Vaios Karanikas, and Stefan Evers. "The where, the when, and the how of immune monitoring for cancer immunotherapies in the era of checkpoint inhibition."(2016): 1865-1874.
[3] diagnostics.roche.com/global/en/products/tests/ventana-pd-l1-_sp263-assay2.html
[4] www.agilent.com/en/product/pharmdx/pd-l1-ihc-22c3-pharmdx/pd-l1-ihc-22c3-pharmdx-for-autostainer-link-48-94448
[5] www.agilent.com/en/product/pharmdx/pd-l1-ihc-28-8-pharmdx/pd-l1-ihc-28-8-pharmdx-for-autostainer-link-48-76917
[6] diagnostics.roche.com/global/en/products/tests/ventana-pd-l1-_sp142-assay2.html
[7] www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?ID=394004
[8] www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ucm301431.htm
[9] www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P150027
[10] Ratcliffe, Marianne J., et al."Agreement between programmed cell death Ligand-1 diagnostic assays across multiple protein expression cutoffs in non–small cell lung cancer."Clinical Cancer Research (2017).
[11] Hirsch, Fred R., et al."PD-L1 immunohistochemistry assays for lung cancer: results from phase 1 of the blueprint PD-L1 IHC assay comparison project."Journal of Thoracic Oncology 12.2 (2017): 208-222.
[12] Tsao MS, Kerr KM, Kockx M, Beasley MB, Borczuk AC, Botling J, Bubendorf L, Chirieac L, Chen G, Chou TY, Chung JH. PD-L1 immunohistochemistry comparability study in real-life clinical samples: results of Blueprint phase 2 project. Journal of Thoracic Oncology. 2018 May 22.




 苏公网安备 32011402011742
苏公网安备 32011402011742